Tabla para comparar las teorías ácido-base.
La siguiente tabla muestra las distintas teorías realizadas acerca del ácido-base:
Teoría ácido-base |
Definición de ácido |
Ejemplo de ácido |
Definición de base |
Ejemplo de base |
|---|---|---|---|---|
Arrhenius |
Especie que aumenta la concentración de iones hidrógeno, H⁺, en una solución acuosa. Los iones H⁺ reaccionan inmediatamente con el H₂O para formar iones oxidanio (H₃O⁺). |
HCl(ac)→H+(ac)+Cl–(ac) |
Especie que aumenta la concentración de iones hidróxido, OH–, en una solución acuosa. |
NaOH(ac)→Na+(ac)→OH–(ac) |
Brønsted-Lowry |
Especie que dona un protón, H⁺. *El agua se define como sustancia anfótera ya que puede actuar como ácido o base.* *Ácido conjugado es la especie que se forma cuando una base de Brønsted-Lowry acepta un protón.* |
NH3(g)+HCl(g) → NH4Cl(s) * También se expresa como 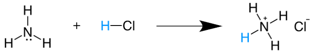 * Ácido conjugado 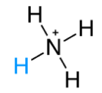 |
Especie que acepta un protón, lo que requiere un par solitario de electrones para enlazarse al H+. *Base conjugada es la especie que se forma después de que un ácido de Brønsted-Lowry cede un protón.* |
NH3(ac)+H2O(l⇌NH4+(ac)+OH–(ac) *Base conjugada OH–(ac) |
Lewis |
Especie que acepta y comparte un par de electrones cedidos por una base. |
Ácido + Base → aducto H++ :NH3 |
Especie que cede un par de electrones y los comparte con un ácido. |
Ácido + Base → aducto 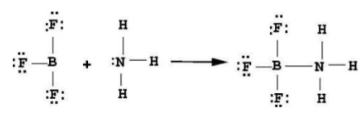 |
Ejemplos de reacciones ácido base según las diferentes teorías.
Reacción |
Arrhenius |
Brønsted-Lowry |
Lewis |
Comentario |
|---|---|---|---|---|
HCl + NaOH → NaCl + H2O |
Ácido + Base → Sal + Agua
HCl + NaOH → NaCl + H2O |
Ácido + Base → Base conj. + Ácido conj.
HCl + NaOH → NaCl + H2O |
Ácido + Base → aducto
HCl + NaOH → NaCl + H2O |
|
H2PO4– + HCl → H3PO4 + Cl– |
No aplica |
Ácido + Base → Ácido conj. + Base conj.
H2PO4– + HCl → H3PO4 + Cl– |
Ácido + Base → aducto
H2PO4– + HCl → H3PO4 + Cl– |
* La teoría de Arrhenius no aplica porque es necesario un ion OH para la definición. |
AlCl3 + NH3 → [Al(NH3)Cl3] |
No Aplica |
No aplica |
Ácido + Base → aducto
AlCl3 + NH3 → [Al(NH3)Cl3] |
* Todos los ácidos y bases de Brønsted-Lowry son ácidos y bases de Lewis, pero no todos los ácidos y bases de Lewis son de Brønsted-Lowry. |
Encuentre más artículos aquí: https://carbotecnia.info/aprendizaje/







