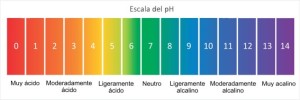
pH del agua
Al la pregunta de ¿Qué es el pH? es una medida de la concentración de iones hidrógeno (H+) en una solución acuosa. El término proviene del latín pondus hydrogenii (“cantidad de hidrógeno”). No solo nos enfocaremos al pH del agua, si no que hablaremos del pH en general.
Más adelante se muestra que la concentración de iones hidrógeno tiene una relación directa con la concentración de iones hidróxido (OH–), por lo que el pH también es una medida de la concentración de estos últimos.
¿Qué importancia tiene el pH?
El pH del agua determina la solubilidad (cuánto puede disolverse en ella) y la biodisponibilidad (cuánto pueden consumir los organismos acuáticos) de sustancias químicas como nutrientes (fósforo, nitrógeno y carbono) y metales pesados (plomo, cobre, cadmio, etc.). Por ejemplo, además de afectar la cantidad y forma de fósforo que es más abundante en el agua, el pH también determina si está disponible para los organismos acuáticos. En el caso de los metales pesados, la solubilidad determina su toxicidad. Los metales son más tóxicos a valores de pH más bajos porque son más solubles.
¿Cómo podemos medir el pH?
El pH es una medida importante del agua y se mide comúnmente en puntos de muestreo y en laboratorios. Hay muchos modelos de medidores de pH, pequeños desde tiras reactivas, electrónicos de bolsillo o instrumentos más precisos de laboratorio. Hay modelos portátiles que se pueden llevar al campo y modelos más grandes como este que se pueden usar en el laboratorio.
Para usar el medidor de pH que se muestra a continuación, coloque la muestra de agua en el vaso de precipitados e inserte la sonda de vidrio en el extremo del brazo extensible en el agua. Dentro del bulbo de vidrio delgado al final de la sonda hay dos electrodos potenciométricos. Uno de los electrodos está en un líquido con una acidez o pH ajustado. El segundo electrodo reacciona con la acidez de la muestra de agua. El voltímetro en la sonda mide la diferencia de potencial entre los dos electrodos. El medidor luego convertirá la diferencia de voltaje a pH y lo mostrará en la pequeña pantalla principal. Medidor de pH electrónico digital. Fuente/Aplicación: Dominio Público. Medidor de pH electrónico portátil. El medidor debe estar “calibrado” antes de tomar una medida de pH. Sumerja la sonda en una solución de pH conocido, como agua limpia con un pH neutro de 7.0. La perilla en la caja se usa para calibrar el medidor ajustando el pH mostrado al pH conocido de la solución.
El pH metro
Es un potenciómetro que mide el pH entre dos electrodos. Un electrodo suele ser de plata o cloruro de plata y existe otro que suele ser de vidrio que es sensible a los hidrogeniones.
Reactivos de pH
Los reactivos pueden ser encontrados en tiras o en gotas. La forma de usar es muy sencilla. Se echan algunas gotas en la muestra y dependiendo el color que tome el liquido podremos determinar si es acido, alcalino o neutro.
Las tiras tienen un procedimiento similar, las tiras se deben mojar las tiras y cambiaran de color.
Importancia de medir el pH
El pH desempeña un papel muy importante en el procesamiento de acuicultura, agricultura, alimentos y otras tantas industrias más.
Las razones más importantes para hacer la medición son las siguientes:
- Para producir productos con propiedades
- Para producir productos de manera eficiente a un costo óptimo
- Evitar problemas de salud en los consumidores
- Cumplir con los requisitos reglamentarios
Ácidos y Bases
Los pares ácido-base pueden neutralizarse entre sí, al igual que H y OH- en esta ecuación. Por definición, un ácido es una sustancia que reduce el pH cuando se agrega al agua purificada. De manera similar, una base es una sustancia que eleva el pH del agua. Para definir esto con mayor precisión, Arrhenius en 1884 descubrió que los ácidos liberan iones de hidrógeno (H) cuando se disuelven en agua, mientras que las bases liberan iones de hidrógeno (H) cuando se disuelven en agua. agua ion hidroxilo (OH-) en agua. . Sin embargo, algunas sustancias cumplen la definición de actividad (cambio de pH) pero no la definición de Arrhenius (liberación de iones). Para resolver este problema, Bronsted y Lowry redefinieron los ácidos y las bases: los ácidos liberan iones de hidrógeno o protones (equivalente de H) y las bases aceptan iones de hidrógeno o protones. Esto significa que los ácidos y las bases pueden anularse entre sí, como se muestra en la ecuación del agua de la derecha.
Ejemplos de compuestos ácidos, básicos y neutros
Ejemplos de compuestos básicos
Ácidos de baterías: tienen valores de pH entre 0 y 1. Su nivel de ácido es demasiado alto y perjudica a las especies.
Lluvia ácida: se produce por acumulación de ácidos provenientes de fósiles y combustible. Estas lluvias pueden tener un pH entre 2 y 5 en la escala de pH.
Jugo de limón: cuenta con valores de pH entre 2 y 3.
Café: tiene valor de pH igual a 5 o valores parecidos.
Ejemplos de compuestos neutros
Sangre
Leche
Ejemplos de compuestos básicos
Leche de magnesia: se ubica en la tabla de pH entre los valores 10 y 11.
Lejía o cloro: tiene valores de pH alrededor de 13 .
Factores que afectan el pH del agua
El pH del agua se ve afectado por muchos factores, tanto naturales como los hechos por el humano. La mayoría de los cambios naturales ocurren a través de interacciones con los minerales circundantes (especialmente en forma de carbonatos) y otros materiales. El pH también varía con la precipitación (especialmente la lluvia ácida) y las aguas residuales o aguas residuales de la minería. Además, la concentración de CO2 afecta el pH.
Dióxido de carbono y pH
El pH cambia diariamente debido a la fotosíntesis y la respiración en el agua. El grado de cambio depende de la alcalinidad del agua. El dióxido de carbono es la causa más común de la acidez del agua. La fotosíntesis, la respiración y la degradación afectan las fluctuaciones del pH porque afectan las concentraciones de CO2. Los extremos de estos cambios dependen de la alcalinidad del agua, pero a menudo hay fluctuaciones diurnas significativas. El efecto es más medible en aguas con altas tasas de respiración y degradación. Aunque el dióxido de carbono está presente en el agua en estado disuelto (como oxígeno), también puede reaccionar con el agua para formar ácido carbónico:
CO2 H2O <=> H2CO3
Entonces el H2CO3 pierde uno o dos iones de hidrógeno:
H2CO3 <=> HCO3– + H+ …. HCO3– <=> CO32- + H+
Los iones de hidrógeno liberados reducen el pH del agua. Sin embargo, esta ecuación puede funcionar en ambas direcciones dependiendo del pH actual, actuando como su propio sistema amortiguador. A un pH más alto, este sistema de bicarbonato se desplazará hacia la izquierda y el CO32- absorberá el ion de hidrógeno libre.
Dado que el H2CO3 tiene una constante de solubilidad baja (ley de Henry), la reacción suele ser pequeña. Sin embargo, a medida que aumentan los niveles globales de CO2, también lo hace la cantidad de CO2 disuelto, y la ecuación se desarrollará de izquierda a derecha. Esto aumenta el H2CO3, lo que reduce el pH. Con el tiempo, este efecto se ha vuelto más pronunciado en los estudios del pH del océano.
Cuando un electrolito de disuelve en agua, genera un catión y un anión.
El agua también se disocia y lo hace en menor o mayor grado, dependiendo de los electrolitos disueltos en ella.
Originalmente se creía que la reacción de equilibrio que representaba la disociación del agua era:
H2O ? H+ + OH–
H+ es el ion hidrógeno, y OH– es el ion hidróxido. Hoy sabemos que la reacción es:
2 H2O ? H3O+ + OH–
H3O+ es el ion hidronio, y OH– es el ion hidróxido. Para fines prácticos, aún en la actualidad, cuando hacemos referencia al ion hidrógeno, en realidad se trata del ion hidronio. Conforme a esta costumbre, a partir de este punto, llamaremos ion hidrógeno a lo que realmente es el ion hidronio.
La mayoría de las reacciones de disociación alcanzan un equilibrio químico. Cuando este se alcanza, al producto de la concentración de los iones formados (en términos de concentración molar) se le llama “constante de equilibrio de la reacción”. Para el caso del agua:
Kw = [H+] [OH– ]
Kw es la constante de equilibrio de la reacción. Para agua totalmente pura y a 25°C, la concentración molar de iones hidrógeno (en gmol/L) es:
[H+] = 1 x 10-7
Y la concentración molar de iones hidróxido es:
[OH– ] = 1 x 10-7
Por lo tanto:
Kw = [H+] [OH–] = 1 x 10-14 (1)
Esta relación se cumple, aunque el agua en cuestión contenga iones hidrógeno o iones hidróxido provenientes de electrolitos disueltos que se le han agregado.
Por lo tanto, si la concentración del ion hidrógeno disminuye, la concentración del ion hidróxido aumenta en una proporción tal que el producto de ambas concentraciones sigue siendo 1×10-14 a 25°C.
Ya que los valores numéricos de las concentraciones de iones hidrógeno o de iones hidróxido en una solución suelen ser números muy pequeños, el químico Søren Sørensen propuso el pH como como unidad de medida de la concentración de iones hidrógeno en soluciones acuosas:
pH = – log [H+]
El agua se comporta de manera que el rango de valores que puede tener el pH es de 0 a 14.
Para medir la concentración del ion hidróxido, se puede definir el pOH como:
pOH = -log [OH– ]
Es válido obtener el valor negativo del logaritmo de cada sumando que compone la ecuación (1):
-log Kw = -log[H+] – log[OH–] = -log(1 x 10-14)
-log Kw = -log[H+] – log[OH–] = 14
De la definición de pH y de pOH, se puede inferir que:
pKw = pH + pOH = 14
Existen equipos capaces de medir el pH, llamados potenciómetros. Considerando la definición del pH, al aumentar la concentración de iones hidrógeno en el agua, disminuye el pH y al aumentar la concentración de iones hidróxido, aumenta el pH.
También puede observarse que, si disminuye el pH en una unidad, aumentó la concentración de iones hidrógeno 10 veces. En un agua con pH de 5, la concentración de iones hidrógeno es 100 veces mayor que en un agua de pH 7.
Lo mismo aplica hacia el lado opuesto: en un agua con pH de 13, la concentración de iones hidróxido es 100 veces mayor que en un agua con pH de 11.
Como se mencionó anteriormente, Kw depende de la temperatura. Si se mide el pH de una solución acuosa a 25°C y se hace otra medición a esta misma agua a 50°C, el valor del pH será distinto. La siguiente tabla muestra valores de pKw en función de la temperatura.
Cambios de la constante pKw en función de la temperatura
Temperatura (°C) |
pKw = – log[Kw] |
0 |
14.93 |
5 |
14.73 |
10 |
14.53 |
15 |
14.35 |
20 |
14.17 |
25 |
14.00 |
30 |
13.83 |
50 |
13.26 |
Ejemplos de aplicación del pH
- Con pipeta volumétrica, agregamos 10 ml de ácido sulfúrico (H2SO4) al 98% en un matraz aforado de 1 litro. Aforamos con agua destilada y desgasificada. La temperatura del laboratorio es de 20°C. ¿Qué pH tendrá la solución?
Respuesta:
Densidad del H2SO4 al 98% a 20°C: 1.84 g/cm3.
Masa de H2SO4 al 98% agregado = 10 cm3 x 1.84 g/cm3 = 18.4 g.
Cuando se reportan porcentajes en líquidos o en sólidos, si no se hace alguna aclaración, se habla de % en peso. Por lo tanto, la masa de ácido sulfúrico puro agregado al matraz es:
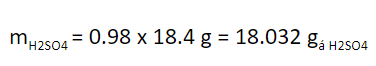
Convertimos a mol, dividiendo entre la masa molar del H2SO4 (98 g/mol):
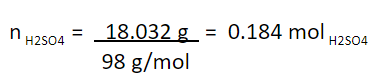
Concentración molar de la solución obtenida: 0.184 mol H2SO4/L.
Los ácidos fuertes, como el sulfúrico, se disocian totalmente en agua. Por lo tanto, todo el hidrógeno que forma parte de este ácido quedará como ion. De esto, la concentración de hidrógeno en la solución será:
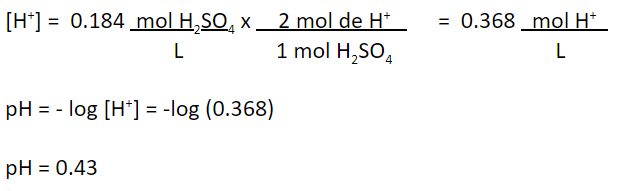
2. Se tiene un agua con un pH de 13.7. Se sabe que se obtuvo, mezclando una solución de sosa (NaOH) líquida al 50% con agua destilada y desgasificada. La temperatura es de 25°C. ¿Cuál es la concentración de sosa en la solución, en términos de mg de NaOH/L?
Respuesta:
pH = 13.7
A 25°C,
pH + pOH = 14.0
pOH = 14 – pH = 14 – 13.7
pOH = 0.3
pOH = -log [OH–]
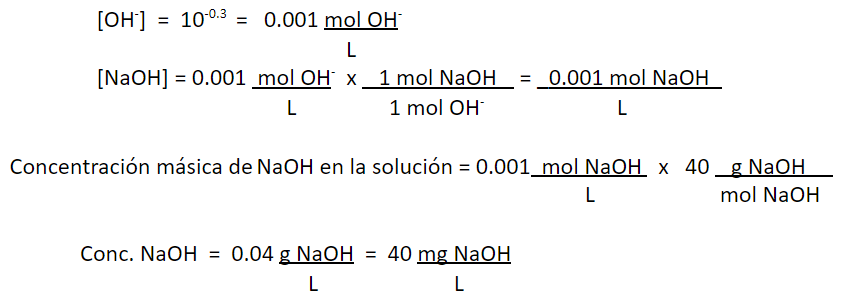
Fuente: https://es.wikipedia.org/wiki/PH
-
RoQuest 4000 Coagulante líquido para materia orgánica Avista
Cotizar -
RoQuest 3000 Coagulante líquido orgánico de Avista
Cotizar -
Vitec 7400 de Avista para control de Sílice y Sulfatos
Cotizar -
RoClean L403 limpiador de incrustaciones por carbonato de calcio y metales de Avista
Cotizar -
RoClean P111 limpiador de membranas por bioincrustaciones
Cotizar -
RoClean P303 Limpiador de incrustaciones por carbonato de calcio y metales
Cotizar -
RoClean L211 limpieza de membranas con ensuciamiento de materia orgánica
Cotizar -
RoClean P112 Limpiador de membrana para Sílice SiO2
Cotizar