El fascinante átomo de carbono
La vida en nuestro planeta es posible gracias a dos fenómenos que constituyen una rareza en el mundo de la química: el enlace de hidrógeno (erróneamente llamado puente de hidrógeno) y la catenación del carbono.
En el caso de la molécula de agua, H2O, el enlace de hidrógeno es una fuerza de atracción que ocurre entre el hidrógeno de una molécula, y el oxígeno de otra molécula. Esta atracción se debe a que el hidrógeno es electropositivo, y el oxígeno, electronegativo. Sin el enlace de hidrógeno, el agua no podría existir en estado líquido o sólido a la temperatura ambiental de la Tierra. Sería un gas, al igual que todos los compuestos cuyas moléculas tienen una masa molar tan baja como la del agua.
Por otro lado, la catenación es la capacidad de un elemento para formar cadenas; es decir, para unirse químicamente consigo mismo. El carbono no es el único elemento que tiene esta capacidad, pero es el que más tiende a hacerlo, y en las formas más variadas.
El átomo de carbono
El símbolo del átomo de carbono es “C”. En el idioma español, no es lo mismo “carbono” que “carbón”. “Carbono” es el nombre del elemento, y “carbón” es un sólido formado principalmente por cadenas de átomos de carbono. El carbono que se encuentra en la Tierra, se creó hace unos 5000 millones de años, durante el periodo de formación del sistema solar, en el que prevaleció la química de fusión nuclear, y mostró ser relativamente estable. Esto le permitió aportar una cantidad que representa el 0.02% en peso de todos los elementos. Aunque este porcentaje parece bajo, el carbono es el décimo segundo elemento más abundante en nuestro planeta. Seguimos hablando del ciclo del carbono a continuación, pero antes es importante señalar ¿Qué es el carbono?
Elemento del carbono
El carbono pertenece al grupo 14 de la tabla periódica, cuyos elementos son: carbono (C), silicio (Si), germanio (Ge), estaño (Sb) y plomo (Pb). Los primeros tres son no metales, y los últimos dos son metales. Todos estos elementos comparten la capacidad de catenación, pero ninguno de ellos lo hace con tanta facilidad como el carbono.
Además de concatenarse, el carbono puede hacerlo mediante enlazamiento múltiple, lo que significa enlazarse entre sí mediante enlaces dobles y triples. Esta última propiedad es común al nitrógeno y al oxígeno, pero en dichos casos, la catenación es relativamente poco frecuente.
Los átomos de carbono pueden unirse entre sí en una variedad de formas y en una cantidad de átomos, imposible para cualquier otro elemento. Pueden formar cadenas de miles de átomos o anillos de todos los tamaños; estas cadenas y anillos pueden tener ramificaciones. A los carbonos de estas cadenas y anillos se unen otros átomos; principalmente hidrógeno, oxígeno, flúor, cloro, bromo, yodo, nitrógeno, azufre, fósforo…
Esta particular característica es la que permite que existan tantos compuestos de carbono. El número de compuestos que contienen carbono es varias veces mayor que el número de sustancias que no lo contienen. El carbono es muy importante para conservar la vida del planeta, uno de los aportes más importantes es la fotosíntesis que se explica a continuación:
El surgimiento de la vida y el proceso de conversión del CO2 en moléculas orgánicas a través de la fotosíntesis gracias al ciclo del carbono.

Durante la formación de la Tierra, su atmósfera se componía principalmente de vapor de agua, dióxido de carbono y nitrógeno, junto con otros gases emitidos por la acción volcánica. La vida inició con los vegetales hace unos 3000 millones de años, en las aguas tibias de los océanos y los mares, y originalmente en formas de plantas primitivas. Esta forma de vida evolucionó debido a su habilidad para fotosintetizar, tomando como materia prima el dióxido de carbono de la atmósfera, y reemplazándolo por oxígeno. En el proceso de fotosíntesis, la planta convierte el CO2 en las cadenas de celulosa y demás moléculas que la conforman, y que, como veremos adelante, los químicos han denominado moléculas orgánicas.
Las primeras formas de plantas y algas crecieron en una abundancia masiva a lo largo de millones de años. Las formas de vida animal evolucionaron mucho después, probablemente hace alrededor de 2000 millones de años, y fueron totalmente dependientes del oxígeno generado por la flora de ese tiempo.
Los animales herbívoros se alimentan de plantas, y los animales carnívoros se alimentan de otros animales. Por lo tanto, todos los seres vivos, plantas y animales, partimos del CO2 como materia prima para formar nuestros tejidos. Podemos estar conscientes, entonces, de que todos nuestros tejidos fueron CO2.
El principal compuesto presente en el cuerpo humano es el agua, pero en segundo lugar están las moléculas orgánicas a base de cadenas de carbono. Por lo tanto, el oxígeno representa la mayor parte de la masa del cuerpo humano (65%), pero en segundo lugar está el carbono (18%). El 99 % de la masa del cuerpo humano está formada por seis elementos: oxígeno, carbono, hidrógeno, nitrógeno, calcio, y fósforo. El contenido de los elementos aluminio y silicio, aunque son muy abundantes en la Tierra, es muy bajo en el cuerpo humano.
La química orgánica o química de las cadenas de carbono
Originalmente, los compuestos químicos se dividieron en dos grupos: inorgánicos y orgánicos, según de dónde provenían. Los compuestos inorgánicos eran aquellos que provenían de los minerales, y los orgánicos, los que se obtenían de fuentes vegetales y animales, o sea: de materiales producidos por organismos vivos. Hasta más o menos 1850, muchos químicos creían que los compuestos orgánicos debían tener su origen en organismos vivos y, en consecuencia, jamás podrían ser sintetizados a partir de sustancias inorgánicas.
Todos los compuestos de fuentes orgánicas contenían el elemento carbono. Aún después de que quedó establecido que estos compuestos no necesariamente debían provenir de fuentes vivas, ya que podían sintetizarse en el laboratorio, resultó conveniente mantener el nombre orgánico para describirlos, y es así que hasta la fecha, los compuestos se clasifican en inorgánicos y orgánicos.
Los compuestos orgánicos se han agrupado en familias que, en general, no tienen equivalentes entre los inorgánicos.
La química orgánica ha desarrollado métodos para descomponer moléculas complicadas, para reordenar los átomos y generar moléculas nuevas, para agregar átomos a las moléculas existentes o para sustituir átomos nuevos por antiguos. Su objetivo es sintetizar nuevas moléculas que proporcionen soluciones o mejoras a las actividades humanas. Actualmente se conocen alrededor de 16 millones de compuestos orgánicos, y cada año se conocen otros 500,000.
La formación de los yacimientos de petróleo, y de las minas de carbón
El petróleo y el gas natural son compuestos orgánicos que se formaron a partir de la materia orgánica acumulada en sedimentos del pasado geológico, y en asociación con materia inorgánica de los mares a lo largo de millones de años.
Por otro lado, hace alrededor de 500 millones de años, la flora había evolucionado considerablemente, y pasó de las aguas tibias de los mares, a la tierra. Al entrar en la era carbonífera, ocurrió un crecimiento masivo en la forma de selvas tropicales. En este tiempo, también los continentes se dirigían lentamente hacia el norte, a través de los climas más cálidos de las regiones ecuatoriales, con sus tormentas torrenciales.
El desplazamiento continental con las depresiones y levantamientos correspondientes de la corteza terrestre, provocaron que áreas crecientes de estas selvas tropicales, lentamente y a través de millones de años, quedaran sumergidas en estuarios de ríos y en el mar. No todos los árboles de las selvas que crecieron a lo largo de un periodo de alrededor de 300 millones de años formaron minas de carbón. Probablemente solo uno de cada mil billones (1 x 1015) de árboles terminó en una mina de carbón. El resto, simplemente se descompuso en compuestos gaseosos y minerales.
Formación de carbón
Una importante etapa en la formación de carbón, a partir del material de estas selvas tropicales, fue el pantano, con su materia botánica descompuesta por bacterias aeróbicas y anaeróbicas, para crear el material residual que se convirtió en carbones, bajo subsecuentes influencias de tiempo, temperatura y presión, asociadas al entierro de material, normalmente a distancias profundas.
Este proceso de carbonización continuó debajo de la tierra, mientras que los continentes se movían hacia el norte hasta la posición en la que se encuentran actualmente. Las propiedades de los carbones de las distintas zonas carboníferas del mundo no son idénticas, incluyendo los carbones que se encuentran a diferentes niveles dentro de una misma beta. Algunos carbones se formaron mucho tiempo después de que había terminado la era carbonífera; es decir, en el periodo cretáceo, asociado con los dinosaurios.
La antracita, carbones minerales y ligníticos.
Los carbones más viejos o más maduros son las antracitas, y que esencialmente no se funden al calentar. Los carbones minerales, es decir, los de edad intermedia, se funden al calentar. Estos carbones son los que se utilizan para fabricar coque metalúrgico para las industrias de producción de fierro y acero.
Los carbones más jóvenes son los lignitos y los carbones marrones, que son relativamente ricos en oxígeno e hidrógeno.
Por lo tanto, las materias primas de la industria del carbón se asocian claramente con los minerales fósiles del mundo. Debido al extenso rango de condiciones geológicas que existieron en la formación, tanto de petróleo como de carbón, se entiende que estos materiales exhiben considerable variación en sus propiedades físicas y químicas. Dichas diferencias llevan a distintos usos de estos materiales, particularmente en las industrias de producción de fierro y aluminio.
Los isótopos del carbono, y el carbono-14 como método para medir la edad de restos de origen orgánico
Lo que define a cada elemento es el número atómico, que corresponde al número de protones contenidos en su núcleo. El número atómico del carbono es 6. Pero cada elemento puede tener distinto número de neutrones. Se denominan isótopos a los átomos de un mismo elemento, cuyo núcleo tiene una cantidad deferente de neutrones. Esto hace que los isótopos difieran en su masa atómica.
El carbono natural tiene tres isótopos. El más común es el carbono-12 o 12C, que representa el 98.89 % de todo el carbono que existe en la Tierra. Su núcleo está formado por 6 protones y 6 neutrones. El carbono-13 (13C) también es estable, representa el 1.11% del carbono presente en la Tierra, y su núcleo contiene 6 protones y 7 neutrones. Y el carbono-14 (14C) es un isótopo radiactivo del carbono, presente en una pequeñísima cantidad. Su núcleo contiene 6 protones y 8 neutrones.
Tiempo de vida del carbono
La vida media del carbono-14 es de 5730 años. Vida media es el tiempo que tarda la concentración de un elemento o compuesto que se descompone –como es el caso de los radiactivos– en disminuir a la mitad. El carbono-14 se está formando constantemente, a consecuencia de reacciones que ocurren entre los neutrones de los rayos cósmicos y los átomos de nitrógeno de las capas altas de la atmósfera. El neutrón sustituye a uno de los protones de un átomo de nitrógeno, y lo convierte en un átomo de carbono-14.
De esta manera, la producción de carbono-14 es constante y está presente en la atmósfera en pequeñísimas cantidades. Los átomos de carbono-14 reaccionan con el oxígeno gaseoso para formar moléculas radiactivas de dióxido de carbono, las cuales son absorbidas por las plantas en la fotosíntesis.
Las criaturas que comen plantas y las criaturas que se alimentan de las criaturas que comen las plantas contienen todas ellas la misma proporción de carbono-14 radiactivo. Cuando el organismo muere, la ingestión de carbono cesa, y el que ya está presente en el organismo se desintegra. Por tanto, se puede determinar la edad de un objeto midiendo la cantidad de carbono-14 presente en una muestra del mismo. Este método ofrece una escala absoluta para fechar objetos de entre 1,000 y 20,000 años de antigüedad. W. F. Libby se hizo acreedor al premio Nobel de química en 1960 por el desarrollo de la técnica de fechado con radiocarbono.
Los alótropos del carbón
La alotropía es la propiedad de algunas sustancias simples de poseer estructuras moleculares diferentes. Las moléculas formadas por un solo elemento y que poseen distinta estructura molecular se llaman alótropos.
A lo largo de gran parte de la historia se han conocido dos alótropos comunes del carbono: el grafito y el diamante.
Ambos son cristalinos, (es decir, están formados por una estructura molecular ordenada) y los átomos están enlazados con enlaces fuertemente covalentes. Sin embargo, recientemente se ha identificado toda una nueva familia de alótropos, como los fulerenos.
Diamante
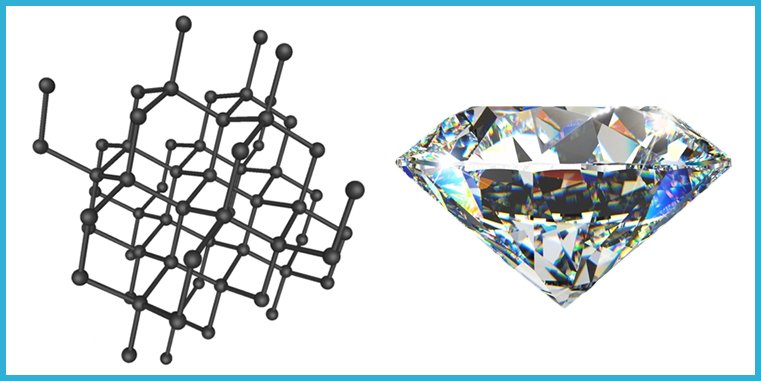
El diamante tiene una estructura tetrahédrica, en la que cada átomo de carbono está unido a otros cuatro mediante enlaces covalentes. Es decir, sus cristales forman un volumen en las tres dimensiones espaciales: largo, ancho y profundo. La estabilidad del enlace entre sus átomos, le da características muy particulares: es el material natural de mayor dureza en la Tierra; su estabilidad impide que los electrones de desplacen a través de él, por lo que es un aislante eléctrico; no obstante, la unión tan rígida entre sus átomos lo hacen un excelente conductor térmico: alrededor de cinco veces mejor que el cobre (y esto es así porque la vibración de un átomo que recibe calor, se transmite a los otros con gran eficiencia, debido a la rigidez de la estructura). Su densidad es de 3.5 g/cm3.
Grafito

La estructura del grafito es muy diferente de la del diamante. El grafito se compone de láminas de átomos de carbono llamadas “grafeno”, paralelas entre sí. La distancia entre las láminas de carbono es relativamente grande, por lo que la atracción entre las capas es muy débil. Esto explica sus propiedades más interesantes: capacidad para conducir la electricidad, debido a que los electrones se desplazan a lo largo de las placas; es un excelente lubricante debido a que las láminas de átomos de carbono pueden deslizarse unas sobre otras; adsorbe (atrapa por atracciones intermoleculares) moléculas de gas entre las capas. Por esta razón, muchos químicos argumentan que en realidad las láminas de grafito se deslizan sobre “rodamientos de bolas”, que son las moléculas de gas.
El grafito se emplea en lubricantes, como electrodo y como mezclas de grafito y arcilla en los lápices de mina. Cuanto mayor es la proporción de arcilla, más “duro” es el lápiz. La mezcla ordinaria se designa como “HB”. Las mezclas con más arcilla (más duras) se designan por medio de diversos números “H”, por ejemplo, “2H”, y a las mezclas con mayor contenido de grafito (más suaves) se les asignan diversos números “B”.
 Placa de grafeno
Placa de grafeno
El grafito puede convertirse en diamante a altas presiones (50,000 atmósferas) y temperaturas (1600oC). De hecho, es un proceso que se aplica industrialmente. Los diamantes obtenidos no tienen las características estéticas adecuadas para usarse como gemas, pero se aplican en brocas para barrenar materiales muy duros.
El descubrimiento de una nueva serie de alótropos de carbono debe considerarse como un hallazgo inesperado. Los fulerenos constituyen una familia de estructuras en las que los átomos de carbono están organizados en una estructura esférica o elipsoidal. Para construir este tipo de estructuras, los átomos de carbono forman anillos de cinco y de seis miembros, en un patrón similar a las líneas de un balón de futbol (el primer nombre que se dio al C60 fue futboleno). La esfera de 60 miembros, C60, el buckminsterfulereno, es el más fácil de preparar y, desde el punto de vista estético, el más bello, pues es una esfera perfecta. La esfera de 70 miembros, C70, es el siguiente fulereno común disponible. La estructura elipsoidal de este alótropo se asemeja a un balón de futbol americano o de rugby.

Esta familia de alótropos se llama así en honor a R. Buckminster Fuller, un genio del siglo XX. Su nombre se asocia en especial con el domo geodésico, un diseño arquitectónico de enorme resistencia, que tiene el mismo arreglo estructural que la molécula del C60.
Los fulerenos también pueden formar tubos con el mismo tipo de estructura (“buckitubos”). Ahora que sabemos de la existencia de estas moléculas, las mismas surgen por todas partes. El hollín ordinario contiene fulerenos, y se les ha encontrado en depósitos naturales de grafito. Algunos astroquímicos arguyen que estas moléculas existen en gran abundancia en el espacio interestelar.

La química de estas novedosas moléculas es hoy día campo de investigación intensa, y las moléculas ya están disponibles en el comercio.
Formas de carbón amorfo o semigrafítico

Un carbón amorfo es aquél en el que las cadenas de carbono que lo conforman no tienen un arreglo cristalino, como en el caso del grafito o del diamante. Y un carbón semigrafítico es un carbón en el que cierta proporción del mismo es grafítico.
Los usos principales del carbón son como fuente de energía y como agente reductor. Para estos fines se utiliza una forma impura de carbón: el coque. Este material se produce calentando hulla en ausencia de aire, un proceso en el que se destruye la compleja estructura de la hulla, se evaporan los hidrocarburos y queda como residuo un sólido poroso, de baja densidad, plateado y de aspecto casi metálico. Los compuestos que se evaporan representan un enorme problema ya que son carcinogénicos. El coque se utiliza en la producción de hierro.
El negro de humo es una forma finamente pulverizada de carbón. Es un micrografito que se produce por la combustión incompleta de materiales orgánicos y se utiliza en cantidades extraordinariamente grandes. El negro de humo se mezcla con el caucho para dar resistencia a los neumáticos y reducir el desgaste. Se utilizan unos 3 kg por cada neumático promedio, y es el contenido de carbón lo que le confiere su color negro.
Otra forma de carbón que se conoce como carbón activado tiene un área superficial muy grande, que suele ser de entre 500 y 1500 m2/g. Su gran área superficial lo hace un gran adsorbente de compuestos covalentes (característica típica de las moléculas orgánicas).
Los bloques de carbón tienen importancia industrial como electrodos en procesos electroquímicos y termodinámicos. Por ejemplo, cada año se utilizan alrededor de 7.5 millones de toneladas de carbón tan solo en las beneficiadoras de aluminio. Y, por supuesto, en el verano siempre aumenta el consumo de carbón vegetal en los asadores de carne domésticos.
Carbonatos y bicarbonatos
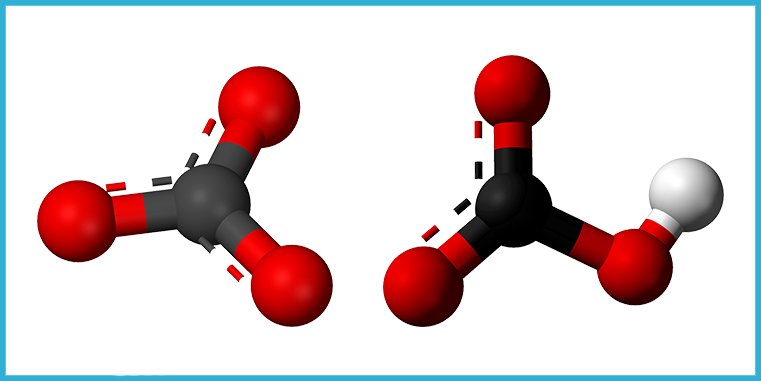
El átomo de carbono también forma compuestos inorgánicos muy comunes en la corteza terrestre y en las aguas, tanto dulces como saladas: los carbonatos, CO3-2. Y los bicarbonatos, HCO3-1. Los más comunes son los de sodio, calcio y magnesio. Estos compuestos, junto con los hidróxidos son los que se conocen como “alcalinidad” en el agua.
¿A qué se le llama ciclo del carbono?
Los átomos de carbono pueden formar moléculas orgánicas en un momento dado, y moléculas inorgánicas en otro momento. A la serie de transformaciones que va sufriendo este elemento, se le llama “ciclo de carbono”.
Este texto no pretende mencionar exhaustivamente las características principales de los compuestos en los que participa el átomo de carbono. Algunos de esos compuestos son de enorme interés para el ser humano. Está, por ejemplo, el tema del efecto invernadero del gas carbónico, CO2, en la atmósfera terrestre; el tema del biochar que es tan benéfico para el cultivo de muchas plantas; el del monóxido de carbono, CO, con tan alta toxicidad para los animales aeróbicos; el tema de los carburos…
Autor:
Germán Groso Cruzado
Bibliografía de contenidos del ciclo del carbono
Choppin, G. R., B. Jaffe, L. Summerlin y L. Jackson, QUÍMICA, Publicaciones Cultural, México, 1974. Ciclo del carbono.
Marsh, H., E. A. Heintz y F. Rodríguez-Reinoso (Eds.), INTRODUCTION TO CARBON TECHNOLOGIES, Publicaciones de la Universidad de Alicante, Alicante, 1997. Ciclo del carbono.
Morrison, R. T. y R. N Boyd, QUÍMICA ORGÁNICA, 3ª Ed., Fondo de Cultura Interamericano, México, 1976. Ciclo del carbono.
Rayner-Canham, G., QUÍMICA INORGÁNICA DESCRIPTIVA, 2ª Ed., Pearson Educación, México, 2000. Ciclo del carbono.
Artículos relacionados:
¿Qué es el carbón activado y para qué sirve?
¿Qué es el número de yodo del carbón activado?
Comparte:
Necesitas más información, escríbenos.
Algunos productos que te pueden interesar
-
AA-3 Carbón activado para reducir color y sabor en tequila y otros destilados
Cotizar -
AAM Carbón activado para eliminar color en tequila y otros destilados
Cotizar -
EBA-9 Carbón activado para tratamiento de tequilas y otros destilados
Cotizar -
IA-4 Carbón activado para tratamiento de tequilas y otros destilados
Cotizar -
Micro K Carbón activado de cáscara de coco
Cotizar -
Micro 4 LF Carbón activado de concha de coco libre de finos
Cotizar -
Megapol C – Carbón activado en polvo de madera
Cotizar -
Megapol E – Carbón activado en polvo de madera
Cotizar